3°AÑO FISICOQUIMICA
La estructura de la materia:La estructura del atomo.
¿Qué es un átomo?
Se conoce como átomo a la unidad más pequeña que constituye la materia.
La palabra átomo proviene del griego antiguo (átomon, "sin división") y fue acuñada por los primeros filósofos en teorizar sobre la composición de las cosas, es decir, las partículas elementales del universo. Desde entonces, con el surgimiento de los modelos atómicos, la forma de imaginarlos ha variado enormemente, a medida que un modelo atómico sucedía al anterior a través de los siglos, hasta llegar al que manejamos hoy en día.
Los átomos tienen las propiedades del elemento químico que componen y, a su vez, los elementos están organizados y clasificados según sus números atómicos, configuración electrónica y propiedades químicas en la Tabla Periódica de los elementos.
Un mismo elemento químico puede estar compuesto por distintos átomos de la misma clase, es decir, con mismo número atómico (número de protones que tiene cada átomo en el elemento), aunque sus masas atómicas sean distintas.
Por ejemplo, existen distintos átomos de un mismo elemento que difieren en su número de neutrones, y son llamados isótopos, un caso representativo son los isótopos del elemento carbono (12C, 13C, 14C). Entonces, cada átomo pertenece a un mismo elemento químico o no, dependiendo de su número de protones, por lo que los átomos con el mismo número de protones pertenecen a un mismo elemento químico.
¿Cómo se compone un átomo?
Los átomos están compuestos por un núcleo y uno o varios electrones (que tienen carga negativa) alrededor de él. El núcleo está compuesto por partículas llamadas protones y neutrones. Los protones tienen carga positiva y los neutrones son neutros. Al conjunto de protones y neutrones se les llama nucleones.
Los protones y electrones se atraen entre sí por la fuerza electromagnética (interacción que presentan las partículas cargadas con campos eléctricos y magnéticos), mientras que los protones y neutrones se atraen entre sí por la fuerza nuclear (fuerza que experimentan únicamente las partículas que componen el núcleo atómico).
¿Cómo se combinan los átomos?
Los átomos pueden combinarse entre sí para formar enlaces químicos, lo que ocurre cuando comparten de una u otra forma sus electrones. Los enlaces químicos pueden ser covalentes, iónicos y metálicos, lo que origina compuestos moleculares covalentes, redes iónicas o compuestos metálicos (aunque es importante aclarar que ningún enlace químico es absolutamente covalente o iónico). De esta forma, los átomos pueden combinarse para formar moléculas sencillas como el agua, así como también para formar macromoléculas complejas como proteínas, ADN y ARN.
Si bien los átomos se distinguen entre sí gracias a la configuración de sus partículas, también es cierto que todos los átomos de un mismo elemento son exactamente idénticos: los átomos de hidrógeno en el Sol son los mismos que los que componen nuestro cuerpo, y los átomos de carbono en el cuerpo de un perro son idénticos a los que componen un diamante. La diferencia está en la forma en que se combinan los átomos para constituir los distintos compuestos químicos que componen los órganos y sistemas de órganos en los seres vivientes, los materiales generados en la industria, y toda la materia que compone el universo.
Actividades n°1:
el átomo está formado por partículas subatómicas,estas partículas son los protones, electrones y neutrones, protones (carga positiva) se encuentra en el núcleo del átomo junto con los neutrones (sin carga) y los electrones (con carga negativa) se encuentran alrededor del núcleo en los orbitales o niveles de energía girando a grandes velocidades.nostros aprendimos cómo sacar la cantidad de partículas que posee cada
átomo, teniendo en cuenta el número másico y el número atómico que se encuentra en la Tabla Periódica y luego lo representaron con la ayuda de un simulador. En esta clase lo que vamos a ver y aprender es como se combinan estos átomos unos con otros para dar nuevas sustancias.
A continuación van a trabajar con un simulador para la realización de iones, pero antes les voy a mostrar un ejemplo:
Teniendo en cuenta la siguiente situación problemática:
Un átomo ha perdido 1 electrón, quedando con 2 electrones.
Se desea saber:
1) A qué elemento corresponde y cuál es su carga.
2) Cuántos protones y cuántos neutrones tiene.
3) Represéntalo.
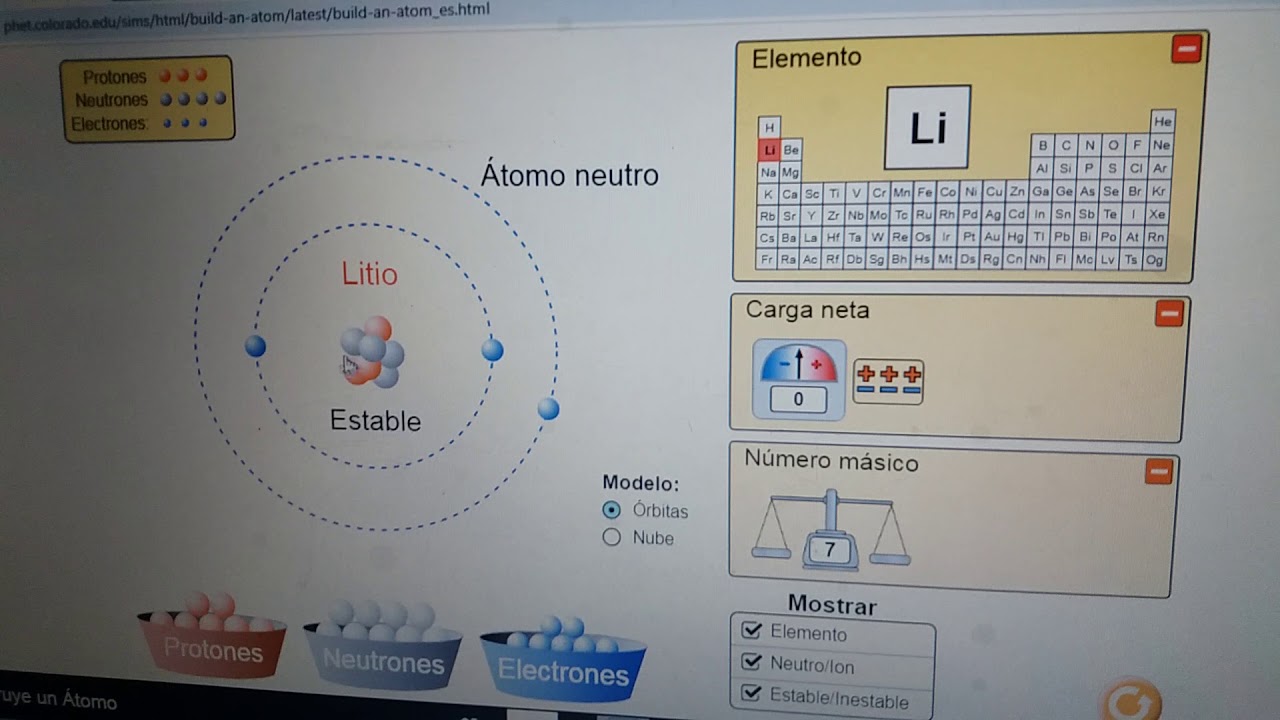
✓ En este caso vamos a realizar una suma entre el electrón que perdió y los 2 electrones con los que quedó ya que deseamos saber la cantidad exacta de cargas negativas que posee el átomo, sin haber perdido electrones. Realizando la operación de un total de 3 electrones. Si buscamos en la Tabla Periódica, el elemento con 3 electrones corresponde al elemento "Litio (Li)". Y representando el ión queda de la siguiente manera:
Li+1
✓ Ahora sacaremos la cantidad de protones, electrones y neutrones que posee este átomo:
✓ Protones: 3
✓ Electrones: 3- 1= 2. (3 es la suma total de electrones, a eso debemos restarle la cantidad de partículas que perdió, en este caso es 1).
✓ Neutrones: 7- 3= 4
Ahora les propongo que realicen los siguientes iones y luego lo representen.
1. Un átomo ha perdido 2 electrones, quedando con 2 electrones. Se desea saber:
a. A qué elemento corresponde y cuál es su carga.
b. Cuántos protones y cuántos neutrones tiene.
c. Represéntalo.
2. Un átomo tiene 8 protones y ha ganado 2 electrones. Se desea saber:
a. A qué elemento corresponde y cuál es su carga.
b. Cuántos electrones y cuántos neutrones posee.
c. Represéntalo.
3. Un átomo tiene 7 protones, ha ganado 3 electrones, indica:
a. A qué elemento corresponde y cuál es su carga.
b. Cuántos electrones y cuántos neutrones posee.
c. Represéntalo.
les dejo el simulador para que con esto se ayuden para realizar la actividad.
Una vez finalizada la actividad enviar los resultados junto con fotos de el simulador de cada elemeno por mail a profe.luisgomez@gmail.com .
Actividades n°2:
Para esta última actividad deberán trabajar con las plantillas
que les voy a entregar o pueden imprimirla del pdf que dejo más abajo, en las
cuales con ayuda de la aplicación podrá identificar la cantidad de electrones y
sus orbitales de cada elemento dado. Con un procesador de texto(Word)o similar deberán
listar cada elemento con su nombre, símbolo, la cantidad de electrones y
cuantos electrones en cada orbital. Solo realizaremos las 3 primeras filas de
la tabla periódica.una vez finalizada la actividad deberan entregarla por mail a .profe.luisgomez@gmail.com
La actividad se realizará con la aplicación átomos ra, la cual se podrá descargar de playstore para luego instalarla en el celular.
Esta actividad deberá ser entregada por mail a profe.luisgomez@gmail.com .
Link de descarga de app: https://play.google.com/store/apps/details?id=com.MasMenos.AtomosRA
Pdf plantilla:
Video tutorial uso de la app:
Actividad N°3
Crear un comic con el programa "comic life" en el cual van a desarrollar el tema "tabla periodica"les dejo un pdf para que puedan tener informacion para crrear el comic. Este comic no tiene que ser estrictamente científico ni académico, pueden desarrollar el tema como mejor les quede cómodos, eso si no se olviden de introducir los conocimientos adquiridos sobre el tema. Una vez finalizada la actividad la tendrán que enviarla por mail a profe.luisgomez@gmail.com .
Link para descargar el programa: https://plasq.com/apps/comiclife/macwin/
EJEMPLO DE COMIC:

pdf tabla periodica:
Tabla by luis gomez
